 |
| cientificosqueayudaron - Caracteristicas y propiedades de la disolucion de Van't Hoff
|
|
|
|
|
|
 |
 |
El holandés Jacobus Henricus van 't Hoff realizó un estudio sistemático de las propiedades coligativas de las disoluciones, que publicó en1885. En este artículo van 't Hoff fórmula una expresión, para disoluciones diluidas, que relaciona la presión osmótica con la concentración del soluto, la cual es similar a la ecuación de los gases ideales y proporciona la primera teoría para explicar la presión osmótica:

donde:
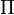 , es la presión osmótica, en atmósferas (atm). , es la presión osmótica, en atmósferas (atm).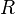 , es la constante universal de los gases ideales (aunque a pesar de su nombre no sólo se aplica a gases, como es el caso). Su valor es de 0,082 atm·L·K-1·mol-1. , es la constante universal de los gases ideales (aunque a pesar de su nombre no sólo se aplica a gases, como es el caso). Su valor es de 0,082 atm·L·K-1·mol-1. , es la temperatura absoluta, en kelvin (K). , es la temperatura absoluta, en kelvin (K). , es la concentración molar o molaridad de la disolución, medida en mol·L-1. , es la concentración molar o molaridad de la disolución, medida en mol·L-1. |
|
¡Hoy había/n 1 visitantes (1 clics a subpáginas) en ésta página!
|
|
 |
|
|
